



کربنات سدیم (سبک و سنگین) | سودای سبک LSA
35,000 تومان
متن سربرگ خود را وارد کنید
| برند |
چینی ,کاوه سودا ,کمکس |
|---|---|
| گرید |
صنعتی |
| نوع |
سبک ,سنگین |
| وزن |
1000 گرم ,500 گرم ,100 گرم ,کیسه 25 کیلوگرمی ,کیسه 50 کیلوگرمی |
کربنات سدیم (سبک و سنگین) | سودای سبک LSA
وزن های ناموجود محصولات سایت را می توانید از طریق تماس با کارشناسان ما تهیه نمایید.
خرید آنلاین ساده و راحت

ارائه برگه آنالیز محصول

امکان بازگردانی در صورت عدم تطابق با آنالیز

امکان ارسال سریع به سراسر کشور

محصولات مشابه
سدیم فلوراید
روغن سیلیکون ۳۵۰ | روغن سیلیکون ۱۰۰۰
سولفات روی
استات سدیم آبدار | استات سدیم خشک
سیلیکاژل آبی و نارنجی
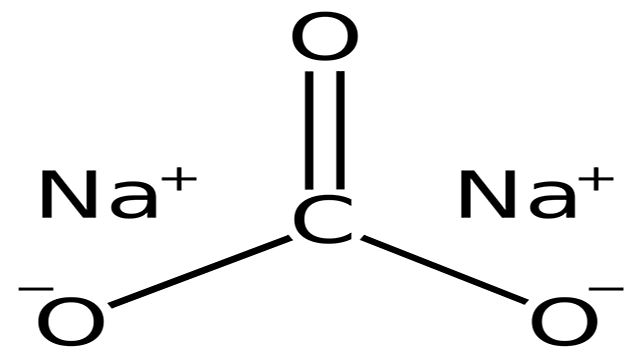
یک ترکیب معدنی و نمکی است که با نام های خاکستر سودا و سدیم تری اکسوکربنات نیز شناخته می شود، کربنات سدیم (sodium carbonate) نام دارد. این ترکیب به عنوان ماده اولیه در بسیاری از واکنش های شیمیایی، نرم کننده آب در تصفیه آب، تولید شیشه، افزودنی غذایی و بسیاری از موارد دیگر کاربرد دارد.
قیمت خرید کربنات سدیم:
برای خرید کربنات سدیم با کیفیت عالی و قیمت مناسب به شیمی استور مراجعه نمایید. شیمی استور ارائه دهنده محصولات شیمیایی با بهترین کیفیت و قیمت به صورت آنلاین است.
کربنات سدیم چیست؟
این ترکیب از قرار گیری دو یون سدیم با بار مثبت و کربنات با بار منفی کنار هم و ایجاد ساختار کریستالی تشکیل شده است. به دو صورت خشک و ده آبه وجود دارد که نوع خشک و بدون آب آن دارای ساختار کریستالی مونوکلینیک و نوع ده آبه آن دارای ساختار کریستالی اورتورومبیک می باشد. به صورت سفید رنگ و بدون بو و جاذب رطوبت است و می تواند رطوبت موجود در هوا را جذب کند. در آب، گلیسیرین و حلال های قلیایی محلول است ولی در حلال هایی مانند الکل ها کم محلول و در کربن دی سولفید، استون، استات ها، بنزونیتریل و آمونیاک نامحلول می باشد.
خواص فیزیکی و شیمیایی
در جدول زیر خلاصه ای از خواص فیزیکی و شیمیایی کربنات سدیم آورده شده است:
| ساختار |
|
| نام دیگر |
دی سدیم کربنات، سودا اش، خاکستر سودا، کریستال سودا |
| فرمول شیمیایی | کربنات سدیم بدون آب: Na2CO3
ده آبه: Na2CO3.10 H2O |
| cas no | 497-19-8 بی آب
6132-02-1 ده آبه |
| وزن مولکولی | خشک: 105.98 g/mol
ده آبه: 286.14 g/mol |
| شکل ظاهری | پودر سفید رنگ بدون بو |
| چگالی | خشک (دمای اتاق): 2.54 g/ml
ده آبه: 1.46 g/ml |
| نقطه ذوب | خشک: 651ºC
ده آبه: 34ºC |
| حلالیت | محلول در آب، گلیسیرین و حلال های قلیایی |
| اسیدیته (pKa) | 10.33 |
روش تولید کربنات سدیم
در ادامه برخی از روش های رایج تهیه این ماده را بررسی خواهیم کرد.
سنگ های معدنی
این ترکیب را می توان از سنگ ترونا که دارای فرمول شیمیایی NaHCO3CO3.2H2O است، استخراج کرد. این سنگ به طور عمده در ایالت متحده استخراج می شود و تقریبا مصرف داخلی این ترکیب را تامین می کند.
همچنین از برخی از دریاچه های دارای آب شور نیز می توان این ماده را تهیه کرد.

فرآیند Leblance
نیکلاس لبلانس در سال 1792 یک روش اختراعی برای تولید کربنات سدیم معرفی کرد. در این فرآیند از اسید سولفوریک، سنگ های دارای کربنات (کربنات کلسیم)، زغال سنگ و نمک استفاده می شود. در مرحله اول، ابتدا نمک کلرید سدیم با اسید سولفوریک تحت واکنش قرار می گیرد که در نتیجه آن سولفات سدیم و اسید کلریدریک تولید می شود.
2NaCl + H2SO4 → Na2SO4 + 2HCl
در مرحله بعدی سولفات سدیم تولید شده تحت واکنش با زغال (کربن) قرار می گیرد تا سدیم سولفیت و دی اکسید کربن تولید شود. و سپس محصول تولید شده با کربنات کلسیم واکنش می دهد تا طی یک واکنش جانشینی دوگانه، خاکستر سودا تولید شود.
Na2SO4 + 2C → Na2S + 2CO2
Na2S + CACO3 → Na2CO3 + CaS
روش سولوی
این روش در سال 1861 توسط ارنست سولوی ارائه شد. در این روش ابتدا کلرید سدیم، آمونیاک، آب و دی اکسید کربن با هم واکنش می دهند تا بی کربنات سدیم و کلرید آمونیوم تولید شود.
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
بی کربنات سدیم تولید شده در مرحله بعد تحت حرارت قرار می گیرد تا کربنات سدیم، آب و دی اکسید کربن تولید شود.
2NaHCO3 → Na2CO3 + H2O + CO2
فرآیند Hou
این فرایند در سال 1930 توسط هو دیبانگ کشف شد. در طی این فرآیند دی اکسید کربن حاصل از واکنش آب و متان، با آمونیاک و آب واکنش می دهد. در مرحله محصول به دست آمده با محلول اشباع کلرید سدیم واکنش می دهد و بیکربنات سدیم تولید می شود. نهایتا با حرارت دادن بیکربنات سدیم، کربنات سدیم تولید می گردد.
NH3 + CO2 + H2O → NH4HCO3
NH4HCO3 + NaCl → NH4Cl + NaHCO3
2NaHCO3 → Na2CO3 + H2O + CO2
تهیه کربنات سدیم از جوش شیرین
این ماده را در فر با دمای 93 درجه سانتی گراد، به مدت یک ساعت گرم کنید. کربن دی اکسید و آب خارج می شود و کربنات سدیم خشک باقی می ماند.
انواع کربنات سدیم
همانطور که گفته شد، این ترکیبات جاذب رطوبت هستند و براحتی می توانند مولکول های آب موجود در محیط یا هوا را جذب کنند. به همین دلیل می توانند به دو صورت نمک خشک و هیدراته وجود داشته باشند.
- کربنات سدیم خشک و بدون آب: این ترکیب با نام سودا کلسینه شده شناخته می شود از حرارت دادن کربنات هیدارته به دست می آید. همچنین در نتیجه فرآیند سولوی در تولید بیکربنات سدیم و کلسینه کردن آن نیز به دست می آید.
- مونوکربنات سدیم: با فرمول Na2CO3.H2O نشان داده می شود و حاوی یک مولکول آب است. با نام کریستال کربنات نیز شناخته می شود.
- کربنات سدیم هفت آبه: که به صورت Na2CO3.7H2O نشان داده می شود.
- کربنات سدیم ده آبه: با فرمول Na2CO3.10H2O نشان داده می شود. ناپایدار است و براحتی تجزیه شده و مونو هیدرات تشکیل می دهد.
همانطور که مشاهده کردید در نوع هیدراته تعداد مولکول های آب می تواند متفاوت و از یک مولکول تا ده مولکول متغیر باشد.
واکنش های کربنات سدیم
در ادامه برخی از واکنش های رایج این ماده را بررسی خواهیم کرد.
واکنش سدیم کربنات با هیدروکلریک اسید
کربنات سدیم بازی ضعیف است و هیدروکلریک اسید، اسیدی قوی است. یونهای +H از HCl با یونهای CO₃²⁻ از Na₂CO₃ واکنش میدهند. فراورده های این واکنش سدیم کلرید، کربن دی اکسید و آب است.
Na2CO3 + HCl → NaCl + H2O + CO2
در طول این واکنش حباب های گاز کربن دی اکسید تولید می شوند که باعث جوشش محلول می شود.
واکنش با اسید سولفوریک
این واکنش شیمیایی به عنوان واکنش خنثی سازی شناخته می شود. بنابراین، اسید سولفوریک با کربنات سدیم واکنش داده و سولفات سدیم با فرمول مولکولی Na2SO4 به دست میدهد. محصولات دیگر دی اکسید کربن و آب هستند.
H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
واکنش با اسید استیک
کربنات سدیم با اسید استیک واکنش می دهد و سدیم استات، گاز دی اکسید کربن و آب تشکیل می دهد.
2CH3COOH+Na2CO3⟶2CH3COONa+H2O+CO2
کاربردهای کربنات سدیم
این ماده کاربردهای بسیاری در صنایع مختلف دارد که در ادامه آنها را بررسی خواهیم کرد.
تولید شیشه
این ترکیب می تواند به عنوان یک جریان برای سیلیس عمل کند و کاهنده نقطه ذوب مخلوط باشد. شیشه به دست آمده از سودا به مقدار ملایمی در آب محلول است.

برای حل این مشکل مقداری کربنات کلسیم به مخلوط مذاب اضافه می کنند تا شیشه نامحلول شود. بطری و شیشه پنجره از مخلوط این ترکیب با کربنات کلسیم و سیلیکون دی اکسید ساخته می شوند.
نرم کننده آب
آب سخت حاوی ترکیبات محلولی مانند کلسیم و یا منیزیم است. از این ترکیب برای از بین بردن سختی موقت و دائم آب استفاده می شود. همانطور که می دانید سودا اش محلول در آب است و در مقابل کربنات منیزیم و کربنات کلسیم در آب نامحلول هستند. بنابراین با اضافه کردن این ترکیب، یون های موجود در آب با کربنات واکنش داده و نمک نامحلول را تشکیل می دهند و در نتیجه از آب جدا می شوند. معادله واکنش آن ها به صورت زیر می باشد:
+Ca2+ + Na2CO3→ CaCO3 + 2Na
+Mg2+ + Na2CO3 → MgCO3 + 2Na
افزودنی غذایی
این ترکیب کاربرد بسیاری در مواد غذایی دارد. باز قوی تری از جوش شیرین است اما از سدیم هیدروکسید یا هیدروکسید پتاسیم ضعیف تر است. از این ترکیب به عنوان تنظیم کننده اسیدیته مواد غذایی، ضد انعقاد و پایدار کننده استفاده می شود. همچنین در تهیه ماکارونی و در چوب بستنی مورد استفاده قرار می گیرد.

از این ماده در تولید پودر شربت استفاده می شود. زمانی که شربت با بزاق ترکیب می شود احساس خنکی در ما ایجاد می شود. این احساس ناشی از واکنش گرماگیر سودا اش با اسیدی مانند اسید سیتریک (خرید اسید سیتریک) است که در طی این واکنش دی اکسید کربن تولید می شود. از طرفی در تولید نیتریت سدیم (خرید نیتریت سدیم) که یک عامل نگهدارنده پر مصرف در صنایع غذایی به ویژه محصولات گوشتی است، حضور دارد.
باز ملایم و ارزان
از این ماده به عنوان باز نسبتا قوی در زمینه های مختلف استفاده می شود. به عنوان یک ماده قلیایی معمولی، در بسیاری از فرآیندهای شیمی به هیدروکسید سدیم ترجیح داده می شود زیرا ارزان تر و ایمن تر از آن است. به عنوان مثال از آن به عنوان تنظیم کننده pH در عکاسی استفاده می شود.
پیش ماده مواد شیمیایی
یکی از روش های مهم برای تولید بیکربنات سدیم استفاده از این ترکیب است. در واقع این ماده طی فرآیند سولوی در واکنش با دی اکسید کربن و آب می تواند بیکربنات را تولید کند.
Na2CO3 + CO2 + H2O → 2NaHCO3
یکی دیگر از واکنش هایی که از این ترکیب در آن استفاده می شود تولید بی سولفیت سدیم است. بی سولفیت سدیم در جداسازی لیگنین از سلولز کاربرد دارد. این واکنش برای حذف دی اکسید گوگرد از گازهای دودکش در نیروگاه ها مورد استفاده قرار می گیرد.
Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
همچنین یکی از کاربردهای این ماده در تولید سولفات منگنز است.
شوینده ها
کربنات سدیم موجود در شوینده ها آب را نرم می کند و به سایر مواد پاک کننده کمک می کند تا آلودگی را از روی پارچه ها بلند کرده و در آب معلق کنند. کربنات سدیم به مواد معدنی که آب را سفت میکنند میچسبد و به مواد شوینده اجازه میدهد تا به خوبی جذب الیاف شود و لباسها را تمیز کند.
صنایع دارویی
کربنات سدیم نمک دی سدیم اسید کربنیک با خاصیت قلیایی کردن است. وقتی کربنات سدیم در آب حل می شود، اسید کربنیک و هیدروکسید سدیم را تشکیل می دهد. به عنوان یک پایه قوی، هیدروکسید سدیم اسید معده را خنثی می کند و در نتیجه به عنوان یک آنتی اسید عمل می کند. “این متن صرفا جهت آموزش و اطلاع رسانی است، توصیه می شود پیش از مصرف با پزشک متخصص مشورت نمایید.”
کشاورزی
کربنات سدیم روی گیاهان اثر مفیدی در کاهش قارچ دارد ولی با این حال، برخی از نگرانی ها در مورد آن به دلیل قسمت اول این ترکیب است. سدیم می تواند برگ ها، ریشه ها و سایر قسمت های گیاه را بسوزاند. همچنین می تواند در خاک بماند و گیاهان بعدی را تحت تأثیر قرار دهد.
پتروشیمی
این ماده شیمیایی در دکل حفاری برای درمان بیشتر انواع آلودگی یون کلسیم در گل های آب شیرین و آب دریا استفاده می شود. برای آلودگی سیمان از بی کربنات سدیم استفاده می شود. یون های کلسیم حاصل از حفاری گچ یا انیدریت، CaSO4، باعث لخته شدن خاک رس و رسوب پلیمری و کاهش pH می شود.
کاغذ سازی
در کاغذ سازی جهت آماده کردن پالپ نیاز به جداسازی الیاف سلولزی از مواد گیاهی است. بسیاری از مواد گیاهی بسیار سخت هستند و برای انجام این کار نیاز به جوشاندن در کربنات سدیم یا هیدروکسید سدیم در pH 12-14 دارند.
کاربردهای دیگر
سایر کاربردهای این ماده شامل:
- تولید متاسیلیکات سدیم
- تولید سود پرک (خرید سود پرک)
- تولید ترکیبات سدیم دار مانند بوراکس
- تهیه بتائین بی آب (خرید بتائین از سایت شیمی استور)
- به عنوان مرطوب کننده در صنعت آجر سازی جهت کاهش میزان آب مورد نیاز در ساخت آجر
- در ریخته گری به عنوان عامل پیوند دهنده به منظور چسباندن آلژینات مرطوب به آلژینات ژله ای استفاده می شود.
است. همچنین این ماده عامل کف کننده و ساینده در خمیر دندان، همچنین تنظیم کننده pH دهان است.
بازار خرید و فروش جهانی:
ارزش بازار جهانی این ماده در سال 2022 برابر با 13.26 میلیارد دلار بوده و انتظار می رود تا سال 2030 به 21.3 میلیارد دلار برد. در واقع رشد 6.10 درصدی را در طی این دوره طی خواهد کرد. این ماده را که اغلب به عنوان سودا اش می شناسند، یک ترکیب شیمیایی معدنی با خواص بازی است و در تهیه شوینده ها، شیشه ها، مواد شیمیایی، محصولات غذایی و غیره به کار می رود.
بزرگترین بازار این ماده در جهان، متعلق به آمریکای شمالی است و حجم زیادی از تولید آن، وابسته به این ناحیه است. افزایش درخواست برای فولاد، مواد الکتریکی و آلومینیوم در طول رشد صنعت، تاثیر به سزای در بازار این ترکیب داشته است. درخواست برای این ترکیب در سال 2022 به اندازه ای زیاد بود که تنها در آمریکا ارزش بازار آن برابر با 20 میلیون دلار بود.
سدیم کربنات را از کجا تهیه کنیم؟
برای خرید این محصول و سایر ترکیبات شیمیایی، به سایت شیمی استور مراجعه نمایید. شیمی استور ارائه دهنده ی محصولات شیمیایی به صورت جزئی و آنلاین با بهترین کیفیت و قیمت است.
عوارض، خطرات و MSDS کربنات سدیم
در برخورد با چشم موجب سوزش و لاکریماتور می شود. بلافاصله چشم ها را با آب فراوان به مدت 15 دقیقه شستشو دهید و پلک ها را در آب بالا و پایین کنید و کمک پزشکی دریافت کنید. موجب تحریک، سوزش و التهاب پوست می شود. ممکن است از طریق پوست جذب شود و به آن آسیب بزند. پوست را با آب فراوان به مدت 15 دقیقه بشویید. پس از کار لباس های آلوده را تعویض نمایید. موجب تحریک و آسیب به دستگاه گوارش می شود. همچنین به محیط داخلی دهان نیز آسیب می زند. فرد را مجبور به استفراغ نکنید. به پزشک مراجعه کنید. در صورت استنشاق مضر است و ممکن است باعث دستگاه تنفسی شود. فرد را از محل تماس دور کرده و به هوای تازه منتقل کنید. در صورت عدم تنفس، تنفس مصنوعی دریافت کنید یا از اکسیژن استفاده کنید.
جمع بندی:
کربنات سدیم یک ترکیب معدنی و نمکی است که به دو صورت خشک و آبدار وجود دارد. این ماده به صورت ماده ای سفید رنگ، بی بو و جاذب رطوبت است. این ماده کاربردهای بسیاری دارد و در تولید شیشه، نرم کننده آب، افزودنی غذایی، پیش ماده مواد شیمیایی، شوینده ها، صنایع دارویی، کشاورزی، پتروشیمی و کاغذسازی استفاده می شود. این ترکیب در طی دوره ی پیش بینی شده تا سال 2030، رشد 6.10 درصدی خواهد داشت. از آنجایی که ترکیبی خطرناک است، می تواند تحریک، سوزش و التهاب را به دنبال داشته باشد. از این رو، پیش از کار با آن حتما MSDS آن را مطالعه نمایید. برای خرید سدیم کربنات با بهترین کیفیت و مناسب ترین قیمت به شیمی استور مراجعه نمایید.
سوالات متداول
Ph کربنات سدیم چند است؟
Ph این ماده بین عدد 10 تا 11 است.
سدیم کربنات ماده ای اسیدی است یا بازی؟
این ماده به عنوان یک باز در نظر گرفته می شود.
آیا سدیم کربنات برای سلامتی مضر است؟
این ماده در مقدار بسیار کم سمی نیست. اما بلع مقدار زیادی از آن عوارض بسیاری و حتی مرگ را به دنبال دارد.
واکنش سدیم کربنات با آب چگونه است؟
این ماده زمانی که در آب حل می شود، اسید کربنیک و سدیم هیدروکسید را تشکیل می دهد.
| برند |
چینی ,کاوه سودا ,کمکس |
|---|---|
| گرید |
صنعتی |
| نوع |
سبک ,سنگین |
| وزن |
1000 گرم ,500 گرم ,100 گرم ,کیسه 25 کیلوگرمی ,کیسه 50 کیلوگرمی |
7 دیدگاه برای کربنات سدیم (سبک و سنگین) | سودای سبک LSA
پس از افزودن محصولات مورد نظر به سبد خرید، لازم است یکی از گزینههای شیوهی "حمل و نقل" را انتخاب نماید. با انتخاب بهترین گزینه، محصول مورد نظر در کوتاهترین زمان به دست شما خواهد رسید. هزینه ارسال در تمامی گزینهها به صورت پس کرایه است؛ بدین صورت که شما پس از دریافت محصول، هزینه ارسال را به متصدی پرداخت مینمایید.
روش ارسال برای تهران:
ارسال مواد شیمیایی توسط شیمی استور برای شهر تهران به سه روش چاپار، پیک و تحویل حضوری انجام میشود.
-
- چاپار: عمده ارسال سفارشات شهر تهران، با چاپار انجام می شود. هزینه آن به صورت پس کرایه است و مرسوله پس از 3 روز کاری به دست شما خواهید رسید.
- پیک: در صورت درخواست شما مشتریان گرامی، امکان ارسال مواد شیمیایی با پیک تنها برای شهر تهران نیز وجود دارد. برای این منظور لازم است با کارشناسان ما در واحد فروش تماس حاصل فرمایید. پس از موافقت در خصوص هزینه ارسال، مرسوله با پیک برای شما فرستاده می شود.
- تحویل حضوری: شیمی استور امکان تحویل حضوری محصولات خریداری شده را نیز برای شما مشتریان گرامی فراهم نموده است. از این رو می توانید برای دریافت محصولات خود، به محل انبار واقع در شور آباد مراجعه نمایید.
در روش های ارسال گفته شده در بالا، هزینه ارسال به صورت پس کرایه است و شیمی استور هیچ دخل و تصرفی در این امر ندارد.
ارسال برای مناطق اطراف تهران:
برای مناطق اطراف شهر تهران، ارسال مرسولات با وزن های پایین توسط چاپار و برای وزن های بالاتر (مانند کیسه و گالن) توسط باربری انجام می شود. در هر دو روش، مرسوله نهایتاً پس از 3 روز کاری به دست شما می رسد.
روش ارسال برای شهرهای غیر از تهران:
ارسال مواد شیمیایی برای شهرهای غیر از تهران، به دو روش چاپار و باربری انجام می شود.
- چاپار: ارسال مواد شیمیایی در وزن های پایین و کارتن، با چاپار امکان پذیر است و مرسوله پس از نهایتاً 3 الی 5 روز کاری به دست شما خواهد رسید.
- باربری: ارسال محصولات شیمیایی در وزن های بالا، به صورت کیسه و گالن با باربری انجام می شود. در این روش نیز، مرسوله پس از 3 روز کاری به دست شما خواهد رسید.
هزینه ارسال با چاپار و باربری برای شهرهای غیر از تهران، به وزن مرسوله و مسافت بین شهر مبدا و مقصد وابسته است.
هزینه ارسال:
هزینه ارسال مواد شیمیایی به فاصله مبدا و مقصد، وزن، ابعاد و ارزش مرسوله وابسته است. پرداخت هزینه ارسال در تمامی روش ها به صورت پس کرایه بوده و شیمی استور هیچ دخل و تصرفی در این امر ندارد.
اطلاع از زمانبندی ارسال:
زمان دریافت محصولات، پس از ثبت سفارش، به شهر مقصد وابسته است:
| شهر مقصد | روش ارسال | زمان دریافت مرسوله |
| تهران | چاپار | 3 روز کاری |
| اطراف تهران | چاپار | 3 روز کاری پس از ثبت سفارش |
| شهرهای غیر از تهران (محصولات با وزن پایین و کارتن) | چاپار | 3 الی 5 روز کاری |
| شهرهای غیر از تهران (محصولات در وزن های بالاتر) | باربری | 3 روز کاری پس از ثبت سفارش |
بسته بندی:
بسته بندی محصولات شیمیایی یکی از فاکتورهای مهم در نگهداری و حمل و نقل ترکیبات شیمیایی است. برخی از ترکیبات شیمیایی دارای خواص منحصر به فردی هستند و لازم است برای حفظ این خواص همواره آنها را دور از نور، گرما و رطوبت نگهداری کرد. همچنین سمیت و قابلیت اشتعال پذیری برخی ترکیبات، موضوعی قابل توجه است. به همین دلیل در انتخاب و نحوه بسته بندی باید موارد ایمنی را در نظر گرفت. اغلب بسته بندی محصولات شیمیایی دارای ویژگی های مشترکی از جمله:
- نفوذ ناپذیر
- کیفیت مناسب
- متناسب با نوع ماده
- مقاومت در برابر عوامل محیطی
و تناسب بین حجم ظرف و حجم محصول درخواستی توسط مشتری است. فروشگاه آنلاین شیمی استور با ارائه محصولات شیمیایی در بسته بندی های خاص، مقاوم، مستحکم، نفوذ ناپذیر و با کیفیت، اطمینان لازم جهت خرید مواد شیمیایی به صورت آنلاین و حمل و نقل آنها در سریع ترین زمان ممکن را برای شما به ارمغان می آورد.
ظروف مصرفی توسط شیمی استور از کیفیت بالایی برخوردار هستند؛ لذا حمل و نقل و نگهداری ترکیبات شیمیایی توسط این بسته بندی ها بسیار راحت و ایمن است. ما در شیمی استور، همواره در تلاش هستیم تا بهترین شرایط جهت بسته بندی، حمل و نقل و ارسال محصولات شیمیایی را برای شما مشتریان گرامی فراهم آوریم.
آخرین محصولات

























کامیاب –
چرا باید از MSDS کربنات سدیم پیروی کرد حتی با وجود سمیت کم آن؟
شیلا عقیلی –
زیرا کربنات سدیم در تماس مستقیم با پوست، چشم یا راه تنفس میتواند موجب تحریک، سوزش یا التهاب شود. همچنین در محیطهای صنعتی احتمال تماس مزمن یا تصادفی با آن وجود دارد که خطرناک است. بنابراین مطالعه و رعایت برگه ایمنی ماده (MSDS) برای پیشگیری الزامی است.
فرخی –
چرا این ترکیب در تولید شیشه اهمیت دارد؟
شیلا عقیلی –
زیرا نقطه ذوب سیلیس (ماده اصلی شیشه) بسیار بالا است. افزودن کربنات سدیم باعث کاهش نقطه ذوب سیلیس شده و فرآیند ذوب و شکلدهی شیشه را تسهیل میکند. اما چون شیشه تولید شده در آب محلول میشود، معمولاً با افزودن کربنات کلسیم این مشکل برطرف میشود.
سروش –
آیا این ماده با فلزات واکنش میدهد؟
شیلا عقیلی –
خیر، کربنات سدیم بهطور مستقیم با فلزات خنثی مانند آهن یا آلومینیوم در شرایط عادی واکنش نمیدهد. اما در صورت ترکیب با آب و ایجاد محیط قلیایی قوی، ممکن است برخی فلزات را در طول زمان دچار خوردگی کند.
جهانی –
چرا در فرآیندهای صنعتی به جای هیدروکسید سدیم از کربنات سدیم استفاده میشود؟
شیلا عقیلی –
زیرا کربنات سدیم از نظر اقتصادی ارزانتر، ایمنتر و آسانتر در نگهداری است. همچنین در برخی فرآیندها که نیازی به باز بسیار قوی نیست، کربنات سدیم به دلیل عملکرد قابل قبول و خطر کمتر، انتخاب بهتری است.
بینا –
واکنش این ماده با آب چه محصولاتی را تشکیل می دهد؟
شیلا عقیلی –
زمانی که این ماده در آب حل می شود سدیم هیدروکسید و کربنیک اسید را می سازد.
قربانپور –
سلام، در شوینده های کارواش چرا از این ماده استفاده می کنند؟
شیلا عقیلی –
سلام، این ماده در پودرهای شوینده کارواش به عنوان تنظیم کننده pH استفاده می شود.
رضوانی –
سلام کربنات سدیم سبک و سنگین چه تفاوتی با یکدیگر دارند؟
شیلا عقیلی –
سلام این دو ترکیبی نفاوتی در ساختار مولکولی ندارند و از این نظر کاملا یکسان هستند، تفاوت این دو نوع در خواص فیزیکی یعنی اندازه کریستال ها و چگالی آنهاست.